|
|
Энтерожермина. Клинические испытания (2009)
15.02.2023 08:14
 Энтерожермина. В ходе клинических испытаний пробиотика Энтерожермина (Sanofi-Aventis, Италия), содержащего Bacillus clausii, была доказана эффективность препарата в профилактике диарейного синдрома, обусловленного применением антибиотиков, в лечении нарушений микрофлоры кишечника.
Энтерожермина рекомендуется к использованию для лечения расстройств пищеварения и нарушения микрофлоры кишечника у взрослых, детей (в том числе младенцев и грудничков), а также при беременности и кормлении грудью.
Состав препарата. Энтерожермина - лекарственное средство, содержащее споры Bacillus clausii, микроорганизма, входящего в состав нормальной микрофлоры кишечника. За счет устойчивости к кислой среде желудка, споры в неизменном виде проникают в кишечник, где превращаются в вегетативные клетки. Препарат способствует восстановлению нормального количественного и качественного состава микрофлоры кишечника, восстанавливает эндогенный синтез витаминов. Препарат устойчив к действию противомикробных препаратов, что делает возможным его прием в период антибиотикотерапии. Структурных аналогов по действующему веществу лекарство Энтерожермина не имеет.
Энтерожермина. Клинические испытанияРоль пробиотических штаммов Bacillus clausii в антихеликобактерной терапии (2009) Авторы: Г.Д. Фадеенко, д.м.н., профессор, Т.Л. Можина, профессор, А.Н. Черняк, к.м.н. ГУ «Институт терапии имени Л.Т. Малой АМН Украины», г. Харьков
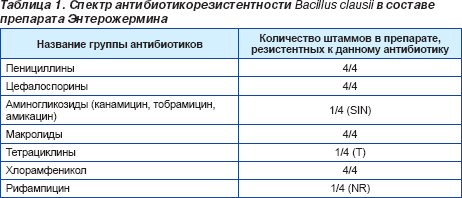
Многочисленные исследования, проведенные с момента открытия микроорганизма Helicobacter pylori, продемонстрировали высокую распространенность хеликобактерной инфекции во всем мире (около 60 % населения земного шара инфицировано этой бактерией), доказали связь между инфицированностью хеликобактериями и развитием функциональной диспепсии, язвенной болезни желудка и двенадцатиперстной кишки, хронического атрофического гастрита, аденокарциномы желудка, MALT-лимфомы. Группой международных экспертов-гастроэнтерологов были разработаны стандарты эрадикационной терапии Helicobacter pylori (Маастрихтский консенсус ІІІ, 2005). Существующие терапевтические схемы, применяемые для эрадикации Helicobacter pylori, основаны на сочетанном применении нескольких антибиотиков и ингибиторов протоновой помпы (ИПП). Одновременное назначение нескольких антибактериальных препаратов не может не повлиять на микробиоценоз тонкого и толстого кишечника. Выраженность побочных явлений вследствие проводимой антибиотикотерапии (диарея, тошнота, рвота, вздутие кишечника, нарушение вкусовых ощущений) регистрируется в 18,2 % случаев и часто приводит к досрочному прекращению приема антибактериальных препаратов, что обусловливает неудачную эрадикацию Helicobacter pylori. Оптимизация лечебных схем должна, с одной стороны, обеспечивать достижение высокого процента эрадикации хеликобактерий, с другой — способствовать сохранению нормального состояния микрофлоры толстого кишечника. Одним из перспективных направлений по предупреждению развития антибиотик-ассоциированных нарушений со стороны кишечной микрофлоры и повышения приверженности пациентов к антихеликобактерной терапии является применение пробиотических препаратов. Практическое руководство Всемирной организации гастроэнтерологов (ВГО) по применению пробиотиков и пребиотиков Probiotics and prebiotics, 2008 [1], а также данные метаанализа 14 рандомизированных исследований [2] отмечают, что дополнительное назначение пробиотиков к стандартной схеме эрадикации H.pylori способствует нивелированию побочных эффектов антибиотикотерапии и улучшает приверженность пациентов к проводимому лечению. Но, как известно, эффект от назначения пробиотических препаратов может существенно снижаться на фоне комбинированной терапии с использованием антибактериальных лекарственных средств. Именно поэтому в клинической практике желательно использовать пробиотические штаммы, устойчивые к воздействию антибиотиков. Среди существующих пробиотиков наше внимание привлек препарат Энтерожермина (sanofi-aventis), содержащий антибиотикорезистентные штаммы Bacillus clausii. В состав препарата входит четыре антибиотикорезистентных штамма Bacillus clausii (OC, NR, T и SIN). Штаммам Bacillus clausii было искусственно придано свойство устойчивости к антибиотикам вследствие включения в их структуру гена антибиотикорезистентности, который позволяет им сохранять все свои пробиотические свойства в условиях одновременного приема с антибактериальными препаратами (табл. 1).
Кроме уже указанных антибактериальных препаратов, штаммы Bacillus clausii обладают резистентностью к тиамфениколу, линкомицину, изониазиду, циклосерину, налидиксовой и пипемидиновой кислотам [3]. В то же время Bacillus clausii чувствительны к карбапенемам, ко-тримоксазолу, фторхинолонам, гликопептидам, оксазолидинонам, стрептограминам [4]. Появление на фармацевтическом рынке Украины пробиотика, содержащего антибиотикорезистентные штаммы Bacillus clausii, сопровождалось опасением, что широкое клиническое применение препарата может привести к передаче гена антибиотикорезистентности патогенным микроорганизмам. Известно, что приобретенная антибиотикорезистентность может возникать вследствие двух различных механизмов: мутаций в конституциональных генах (в этом случае передача гена резистентности не происходит) и приобретения экзогенных детерминант резистентности от других микроорганизмов путем горизонтального (латерального) переноса генов (в этом случае возможна дальнейшая передача гена). В ходе лабораторных исследований штамма Bacillus clausii SIN все попытки передать ген резистентности таким микроорганизмам, как Enterococcus faecalis, Enterococcus faecium, которые являются представителями нормальной кишечной микрофлоры, или Bacillus subtilis, являющемуся филогенетически родственным видом, оказались неудачными. В настоящее время считается, что риск переноса гена антибиотикорезистентности от штаммов Bacillus clausii к другим микроорганизмам является минимальным [4]. Кроме устойчивости к влиянию антибактериальных препаратов, споры Bacillus clausii высокорезистентны к воздействию химических и физических факторов, поэтому легко преодолевают барьер желудочного сока, желчи и попадают в тонкий кишечник, где трансформируются в метаболически активные формы [3, 5]. В тонком кишечнике вегетативные формы Bacillus clausii могут фиксироваться к энтероцитам, заселять слизистую кишечника и оказывать опосредованное влияние на выраженность воспалительной реакции, процессы апоптоза, клеточного роста и дифференциации, трансдукции и транскрипции [6]. Также штаммы Bacillus clausii принимают активное участие в синтезе ряда витаминов, в частности витаминов группы В [3]. Вегетативные формы Bacillus clausii способны индуцировать активность синтетазы NOS II, усиливать синтез интерферона-γ, стимулировать пролиферацию CD4 T-клеток [7]. В настоящее время рассматривается возможность применения Bacillus clausii в качестве транспортного средства для пероральных вакцин [7]. Кроме того, все штаммы Bacillus clausii (OC, NR, T и SIN), входящие в состав препарата Энтерожермина, обладают способностью продуцировать субстанции, обладающие антимикробными свойствами в отношении некоторых грамположительных бактерий: Staphylococcus aureus, Enterococcus faecium и Clostridium difficile, а также рота- и аденовирусов [7]. Однако ни один из пробиотических штаммов Bacillus clausii не обладает активностью в отношении грамотрицательных бактерий, грибов. В некоторых экспериментальных исследованиях in vitro показано отсутствие антигенотоксичности у штаммов Bacillus clausii [8]. Результаты исследования свидетельствуют, что пробиотические препараты, содержащие штаммы Bacillus clausii, могут быть использованы в клинической практике для достижения неспецифического антигенного и антитоксического эффектов [3, 8] при поражении желудочно-кишечного тракта. В ходе клинических исследований пробиотика Энтерожермина (sanofi-aventis), содержащего Bacillus clausii, была доказана эффективность препарата в профилактике диарейного синдрома, обусловленного применением антибиотиков, в лечении нарушений микрофлоры кишечника при проведении эрадикационной терапии H.pylori [9]. С момента начала успешного клинического использования препарата в мировой практике (середина 60-х годов ХХ ст.) до настоящего времени данных о возникновении побочных действий вследствие применения Bacillus clausii не поступало [3]. Одной из вероятных причин хорошей переносимости препарата может быть отсутствие каких-либо балластных веществ, стабилизаторов и консервантов в составе лекарственного средства. Единственным вспомогательным веществом в Энтерожермине является высокоочищенная вода. Часто при проведении антихеликобактерной терапии используют пробиотические препараты, содержащие штаммы Lactobacillus GG, Saccharomyces boulardii или комбинации различных штаммов. Согласно данным некоторых исследований [1], добавление указанных пробиотиков улучшало переносимость эрадикационных терапевтических схем, но не оказывало значительного влияния на приверженность пациентов к проводимому лечению. Экспериментальные и клинические данные показывают, что Bacillus clausii не только предупреждают развитие анитибиотик-ассоциированной диареи, повышают приверженность к лечению, но и увеличивают эффективность эрадикации Helicobacter pylori [1]. Данный постулат базируется на данных рандомизированного двойного слепого плацебо-контролируемого исследования (E. Nista, 2004) [9]. Именно в этом исследовании впервые была убедительно показана более низкая вероятность развития тошноты, рвоты, диареи, абдоминальной боли у пациентов, дополнительно получавших Энтерожермину (Bacillus clausii) в составе схемы эрадикационной терапии. Энтерожермина является новым препаратом для фармацевтического рынка, что обусловливает актуальность проведения данного исследования. Целью нашего исследования явилось изучение эффективности пробиотического препарата Энтерожермина в предупреждении возникновения побочных эффектов на фоне проводимой антихеликобактерной терапии, сохранении видового состава микрофлоры толстого кишечника во время и после окончания эрадикационной терапии. Материалы и методы исследования Исследование проводилось на базе клиники ДУ «Институт терапии имени Л.Т. Малой АМН Украины», г. Харьков. В исследование были последовательно включены 57 пациентов, у которых в ходе обследования была диагностирована пептическая язва двенадцатиперстной кишки, ассоциированная с Helicobacter pylori. В исследование включали лиц обоих полов в возрасте от 18 до 55 лет, страдавших неосложненной язвенной болезнью двенадцатиперстной кишки, инфицированных Helicobacter pylori. Критерии исключения из исследования: — неудачная эрадикация Helicobacterpylori в анамнезе болезни; — осложненное течение язвенной болезни (кровотечение, стеноз, перфорация, малигнизация) или перенесенное оперативное вмешательство на органах желудочно-кишечного тракта; — тяжелые сопутствующие заболевания, в том числе психические расстройства; — беременность и кормление грудью; — недавнее (менее 3 месяцев назад) применение антибактериальных препаратов, соединений висмута, ингибиторов протоновой помпы, ингибиторов H2-рецепторов, слабительных и антидиарейных препаратов, пробиотиков; — злоупотребление алкоголем или наркотиками. Все пациенты давали письменное информированное согласие на участие в исследовании. Диагноз пептической язвы двенадцатиперстной кишки устанавливали на основании данных верхней эндоскопии желудочно-кишечного тракта с использованием видеоэзофагогастродуоденоскопа Olympus (Япония), которую проводили в соответствии с общепринятой методикой. Инфицированность Helicobacter pylori диагностировали на основании результатов быстрого уреазного теста и гистологического исследования биоптата. Бактериологическое исследование микрофлоры толстого кишечника проводили в динамике терапии: до начала эрадикационной терапии и через 28 дней от момента начала терапии. Изучение микробиоты толстого кишечника проводили при помощи посева кала на дисбиоз в соответствии с действующими методическими рекомендациями. Кал гомогенизировали в физиологическом растворе и готовили ряд последовательных десятикратных разведений 103, 105, 107, 108, 109. Посевы культивировали при температуре 37 °С. Идентификацию энтеробактерий и неферментирующих грамотрицательных микроорганизмов проводили после микроскопии колоний и определения цитохромоксидазной активности. Оценку степени нарушения микробного состава в толстом кишечнике (кроме идентификации культур) проводили при помощи количественного учета с перерасчетом на 1 г фекалий. С этой целью подсчитывали количество выросших колоний на чашках, рост в жидких и полужидких питательных средах, количество посеянных фекалий и степень их разведения. Нарушения видового и комплексного состава микрофлоры толстого кишечника оценивали в зависимости от выраженности и степени этих изменений: — 1-ю степень дисбиоза диагностировали при условии уменьшения количества бифидобактерий менее 107 колониеобразующих единиц (КОЕ); — 2-ю степень дисбиоза устанавливали при условии изолированных изменений количественного и качественного состава кишечных палочек в комплексе с уменьшением количества бифидобактерий менее 107 КОЕ; — 3-ю степень — при появлении условно-патогенной флоры более 104 КОЕ в комплексе с уменьшением количества бифидобактерий менее 107 КОЕ и/или изменением количественного и качественного состава кишечной палочки. Эрадикацию Helicobacter pylori проводили в соответствии с рекомендациями Маастрихтского консенсуса III (2005); пробиотический препарат назначали, опираясь на рекомендации Всемирной организации гастроэнтерологов по использованию пробиотиков [1, 10]. Для проведения исследования пациенты были распределены на две группы: — основная группа состояла из 31 пациента, которые были отобраны для получения трехкомпонентной терапии, основанной на применении кларитромицина 500 мг два раза в день, амоксициллина 1000 мг два раза в день, рабепразола 20 мг два раза в день в течение 7 дней и пробиотического препарата Энтерожермина — один флакон три раза в день (каждый флакон содержит 2 × 109 спор Bacillus clausii) на протяжении 21 дня с момента начала антихеликобактерной терапии; — контрольная группа в составе 26 пациентов, которые были отобраны для проведения антихеликобактерной терапии в соответствии со стандартной схемой эрадикационной терапии на протяжении 7 дней без дополнительного назначения препарата Энтерожермина. Эффективность проводимой терапии оценивали через 28 дней от момента начала терапии с использованием следующих параметров: — субъективная оценка ощущений пациентом; — оценка эрадикации Helicobacter pylori (по данным stool-теста); — оценка микробного спектра фекалий (признаками нормализации микробиоценоза толстого кишечника считали отсутствие патогенной и условно-патогенной флоры, восстановление качественно-количественных взаимоотношений микрофлоры). Полученные в ходе работы данные обрабатывали при помощи методов вариационной статистики. Полученные данные считали статистически достоверными при значении р < 0,05 [11]. Все данные представлены в виде М ± m, где М — медиана, m — стандартное отклонение. Результаты и их обсуждение Все пациенты, как в основной, так и в контрольной группе, завершили исследование по протоколу. Досрочного выхода из исследования зафиксировано не было. Основная и контрольная группы были демографически сопоставимы — существенных различий в отношении возраста и гендерной структуры обследованных пациентов между указанными группами не выявлено (табл. 2).
При анализе исходных данных выявлено, что в клинической картине заболевания доминировали болевой и диспептический синдромы. Синдром эпигастральной боли зафиксирован у 93,5 и 92,3 % больных основной и контрольной групп соответственно. Наиболее часто отмечались умеренные боли в эпигастрии и пилородуоденальной зоне, возникающие натощак и в ночное время. Практически у всех обследованных пациентов имел место диспептический синдром — у 96,8 и 92,3 % больных основной и контрольной групп соответственно. Наиболее часто больные жаловались на изжогу, отрыжку воздухом, несколько реже — на метеоризм и тошноту. В динамике наблюдения у всех пациентов была отмечена положительная клиническая динамика симптомов, при этом у больных основной группы, получавших Энтерожермину, купирование диспептического синдрома регистрировали в более ранние сроки, в то время как нивелирование абдоминально-болевого синдрома не имело достоверных различий по сравнению с контрольной группой (табл. 3).
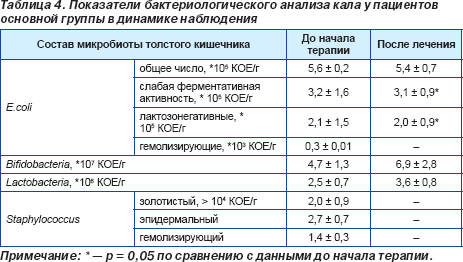
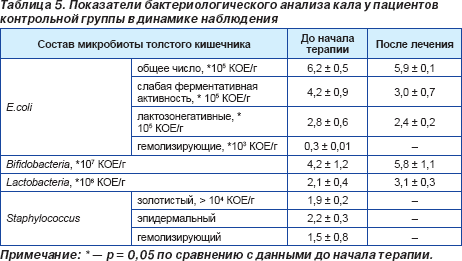
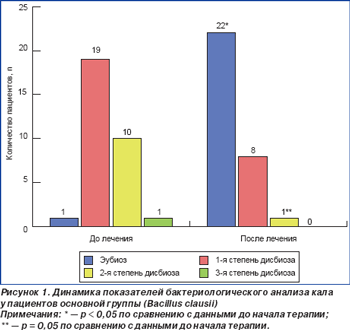
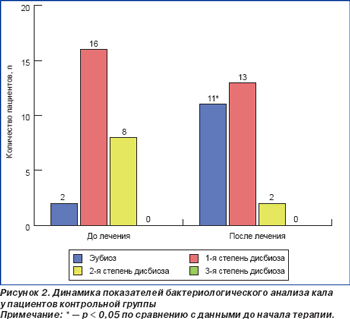
Проведенное исследование микробиоценоза толстого кишечника до начала антихеликобактерной терапии продемонстрировало, что у 48 больных (26 пациентов (83,9 %) основной и 22 пациентов (84,6 %) контрольной группы) имели место нарушения микробиоты разной степени выраженности. Только 9 больных (5 пациентов (16,1 %) основной и 4 пациентов (15,4 %) контрольной группы) не имели нарушений в составе микрофлоры кишечника, т.е. у них диагностировали эубиоз. Выявленные нарушения состава микрофлоры толстого кишечника характеризовались уменьшением или увеличением количества нормальных представителей микрофлоры кишечника, а также увеличением количества условно-патогенной флоры, патогенная микрофлора выделена не была (табл. 4, 5).
До начала эрадикационной терапии дисбиоз 1-й степени диагностирован у 19 больных (61,3 %) основной и 16 больных (61,5 %) контрольной группы, 2-й степени — у 10 (32,6 %) и 8 (30,8 %) больных основной и контрольной группы, 3-й степени — у 1 (3,2 %) и 0 (0 %) пациентов основной и контрольной групп соответственно (рис. 1, 2). Можно предположить, что выявленные нарушения микробиоценоза толстого кишечника у пациентов обеих групп до начала эрадикационной терапии является следствием персистенции хеликобактерной инфекции.
Исследование микробиоты толстого кишечника через 28 дней после начала антихеликобактерной терапии продемонстрировало нормализацию состава микрофлоры толстого кишечника у пациентов обеих групп, при этом число лиц с эубиозом было несколько выше в основной группе. На момент окончания исследования у 22 (70,9 %) пациентов, получавших Энтерожермину, было отмечено нивелирование начальных нарушений микробиоценоза с восстановлением эубиоза. Прием пробиотического препарата сопровождался изменением структуры тяжести дисбиоза: отсутствием больных с дисбиозом 3-й степени, уменьшением числа больных с дисбиозом 2-й степени (р = 0,05) и увеличением количества больных с дисбиозом 1-й степени (р < 0,05) (рис. 1). Данным изменениям сопутствовало возрастание количества пациентов с нормальным содержанием общего числа кишечной палочки, бифидобактерий, снижением количества кишечной палочки с измененными свойствами, эпидермального стафилококка, исчезновением золотистого и гемолитического стафилококков (табл. 5). Антихеликобактерная терапия в контрольной группе также сопровождалась увеличением числа пациентов с эубиозом (р < 0,05) и дисбиозом 1-й степени (р > 0,05), уменьшением количества больных с дисбиозом 2-й степени (р = 0,06), однако данные изменения не имели достоверных значений (рис. 2). При проведении сравнительного анализа выраженности дисбиоза между основной и контрольной группами была зафиксирована более высокая частота достижения эубиоза у лиц, получавших Энтерожермину в ходе проводимой терапии (70,9 %) (р = 0,05), по сравнению с контрольной группой (42,3 %). При сравнении количества пациентов с дисбиозом кишечника 1-й степени была отмечена тенденция к появлению достоверных различий у пациентов, дополнительно получавших Энтерожермину (38,7 % больных основной группы, 50,0 % больных контрольной группы), т.е. у больных, принимавших только стандартную антихеликобактерную терапию, более часто наблюдали развитие дисбиоза 1-й степени. Достоверных различий между формированием дисбиоза 2-й степени у пациентов основной и контрольной групп в ходе антихеликобактерной терапии зафиксировано не было (р > 0,05). При проведении сравнительного анализа состава микрофлоры толстого кишечника до начала и после завершения антихеликобактерной терапии в основной и контрольной группах было установлено, что дополнительный прием пробиотика Энтерожермина не сопровождался достоверным увеличением общего количества E.coli (р = 0,08), однако способствовал уменьшению числа пациентов, у которых в фекалиях обнаруживались лактозонегативные E.coli и E.coli со слабо выраженными ферментативными свойствами и гемолитической активностью (табл. 4). Назначение Энтерожермины больным основной группы не оказало достоверного влияния на содержание бифидо- и лактобактерий (р < 0,05).
Антихеликобактерная терапия в контрольной группе достоверно не влияла на состав микробиоты толстого кишечника (табл. 5). Успешная эрадикация хеликобактерной инфекции была достигнута у 28 (90,3 ± 6,71 %) пациентов основной группы и у 23 (88,4 ± 8,77 %) пациентов группы контроля. Данные, приведенные выше, свидетельствуют о некотором повышении эрадикационной активности антихеликобактерной терапии при дополнительном назначении Энтерожермины. Вместе с тем ограниченное количество пациентов, дополнительно принимавших препарат Энтерожермина, не позволяет дать окончательную оценку полученным данным, хотя результат является обнадеживающим и открывает перспективы для дальнейших исследований в этом направлении. Проводимая терапия не сопровождалась развитием значительных побочных эффектов препаратов в обеих группах, хотя 1 пациент (3,2 %) основной группы и 2 больных (7,7 %) контрольной группы отмечали послабление стула, 3 больных (11,5 %) контрольной группы жаловались на вздутие живота и дискомфорт в эпигастрии, которые не беспокоили их до начала антихеликобактерной терапии. Все пациенты основной группы, получавшие дополнительно Энтерожермину, расценивали свое состояние во время терапии как удовлетворительное, в то время как больные, не принимавшие пробиотик, оценивали свое самочувствие как удовлетворительное в 61,5 % случаев, неудовлетворительное — в 30,8 % случаев и как крайне неудовлетворительное — в 7,7 % случаев. Проведенное нами исследование продемонстрировало, что схема эрадикационной терапии, которая предусматривает дополнительное назначение Энтерожермины при проведении антихеликобактерной терапии, способствует более быстрому купированию клинических проявлений заболевания, активному восстановлению микробиоценоза толстого кишечника (снижению числа условно-патогенных микроорганизмов и повышению числа бифидо- и лактобактерий), что сопровождается повышением эрадикационной активности лечения на фоне хорошей переносимости фармакотерапии. Полученные данные позволяют рассматривать пробиотический препарат Энтерожермина, содержащий штаммы Bacillus clausii, как перспективное лекарственное средство в качестве дополнения стандартной схемы антихеликобактерной терапии при лечении пептических язв двенадцатиперстной кишки, ассоциированных с Helicobacter pylori. Выводы 1. Дополнительное назначение препарата Энтерожермина в составе стандартной антихеликобактерной терапии способствует достоверно более быстрому купированию диспептического синдрома и восстановлению качественного и количественного состава микрофлоры толстого кишечника. 2. Назначение препарата Энтерожермина может быть рекомендовано при проведении эрадикации Helicobacter pylori с целью предупреждения развития нарушений микрофлоры толстого кишечника. 3. Уровень эрадикации Helicobacter pylori при применении пробиотика Энтерожермина является удовлетворительным и составляет 90,3 %. 4. Пробиотическая терапия с использованием препарата Энтерожермина хорошо переносится пациентами и не сопровождается возникновением побочных эффектов.
|
| Технология «Сайт-Менеджер » |